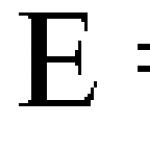"الکل ها" از تاریخ آیا می دانستید که در قرن چهارم. قبل از میلاد مسیح ه. آیا مردم می دانستند چگونه نوشیدنی های حاوی الکل اتیلیک درست کنند؟ شراب از تخمیر آب میوه و توت تولید می شد. با این حال، آنها خیلی دیرتر یاد گرفتند که جزء مست کننده را از آن استخراج کنند. در قرن یازدهم کیمیاگران بخارهای یک ماده فرار را که هنگام گرم شدن شراب آزاد میشد، به دست آوردند. الکلها CxHy(OH) n فرمول کلی الکلهای اشباع تکهیدریک CnH2n+1OH طبقهبندی الکلها بر اساس تعداد گروههای هیدروکسیل CxHy(OH)n الکلهای مونوهیدریک CH3 - CH2 - CH2 OH گلیکولهای دو هیدریک - CH - CH2 OH OH OH طبقه بندی الکل ها بر اساس ماهیت رادیکال هیدروکربنی رادیکال هیدروکربن CxHy(OH)n CxHy(OH)n حد حد CH3 CH3 –– CH CH2 CH2 2 ––CH 2 OH OH CH CH2 غیراشباع غیر اشباع = CH CH––CH CH2 2 = 2 OH OH معطر معطر CH CH2 OH 2 --OH نامگذاری الکلها به جدول نگاه کنید و در مورد نامگذاری الکلها نتیجه بگیرید نامگذاری و ایزومریت هنگام تشکیل نام الکلها، یک (عمومی) ) پسوند به نام هیدروکربن مربوط به الکل اضافه می شود. اعداد بعد از پسوند موقعیت گروه هیدروکسیل را در زنجیره اصلی نشان می دهد: H | H- C – O H | H متانول H H H |3 |2 |1 H- C – C – C -OH | | | H H H پروپانول-1 H H H | 1 | 2 |3 H - C – C – C -H | | | H OH H پروپانول -2 انواع ایزومری 1. ایزومری موقعیت گروه عاملی (پروپانول-1 و پروپانول-2) 2. ایزومریسم اسکلت کربن CH3-CH2-CH2-CH2-OH بوتانول-1 CH3-CH -CH2-OH | CH3 2-methylpropanol-1 3. ایزومری بین طبقاتی - الکل ها نسبت به اترها ایزومر هستند: CH3-CH2-OH اتانول CH3-O-CH3 دی متیل اتر نتیجه گیری نام الکل های تک هیدریک از نام هیدروکربن با طولانی ترین زنجیره کربنی تشکیل شده است. حاوی یک گروه هیدروکسیل با افزودن پسوند -ol برای الکل های چند هیدروکسی، قبل از پسوند -ol در یونانی (-di-، -tri-، ...) تعداد گروه های هیدروکسیل نشان داده شده است. برای مثال: CH3-CH2-OH اتانول انواع ایزومریسم الکل ها ساختاری 1. زنجیره کربنی 2. موقعیت های گروه عاملی ویژگی های فیزیکی الکل های پایین تر (C1-C11) مایعات فرار با بوی تند هستند. الکل های بالاتر (C12- و بالاتر) جامداتی با بوی خوش هستند. خصوصیات فیزیکی نام فرمول Pl. g/cm3 tpl.C tp.C متیل CH3OH 0.792 -97 64 اتیل C2H5OH 0.790 -114 78 پروپیل CH3CH2CH2OH 0.804 -120 92 ایزوپروپیل CH3-CH(OH)CH2CH2CH2-CH20-CH2. 8 10 -90 118 ویژگی ها خواص فیزیکی: حالت تجمع متیل الکل (اولین نماینده سری همولوگ الکل ها) مایع است. شاید وزن مولکولی بالایی داشته باشد؟ خیر بسیار کمتر از دی اکسید کربن. بعدش چیه؟ R – O … H – O …H – O H R R معلوم می شود که همه چیز مربوط به پیوندهای هیدروژنی است که بین مولکول های الکل ایجاد می شود و از پرواز مولکول های جداگانه جلوگیری می کند.ویژگی خواص فیزیکی: حلالیت در آب الکل های پایین تر در آب محلول هستند، بالاتر الکل ها نامحلول هستند چرا؟ CH3 – O…H – O…N – O N H CH3 اگر رادیکال بزرگ باشد چطور؟ CH3 – CH2 – CH2 – CH2 – CH2 – O ... H – O H H پیوندهای هیدروژنی برای نگه داشتن یک مولکول الکل که بخش نامحلول زیادی دارد بین مولکول های آب بسیار ضعیف هستند ویژگی خواص فیزیکی: انقباض چرا حجم هرگز استفاده نمی شود. حل مسائل محاسباتی اما فقط با جرم؟ 500 میلی لیتر الکل و 500 میلی لیتر آب را مخلوط کنید. ما 930 میلی لیتر محلول دریافت می کنیم. پیوندهای هیدروژنی بین مولکول های الکل و آب به قدری قوی است که حجم کل محلول کاهش می یابد، "فشرده سازی" آن (از لاتین contraktio - فشرده سازی). برخی از نمایندگان الکل ها الکل مونوهیدریک - متانول مایع بی رنگ با نقطه جوش 64 درجه سانتیگراد، بوی مشخصه آن سبک تر از آب است. با شعله بی رنگ می سوزد. به عنوان حلال و سوخت در موتورهای احتراق داخلی استفاده می شود متانول یک سم است اثر سمی متانول بر اساس آسیب به سیستم عصبی و عروقی است. مصرف 10-5 میلیلیتر متانول منجر به مسمومیت شدید و 30 میلیلیتر یا بیشتر منجر به مرگ میشود. سبک تر از آب در هر رابطه ای با او مخلوط می شود. به راحتی قابل اشتعال است، با شعله آبی مایل به درخشان می سوزد. دوستی با پلیس راهنمایی و رانندگی آیا مشروبات الکلی با پلیس راهنمایی و رانندگی دوست هستند؟ اما چگونه! آیا تا به حال توسط بازرس پلیس راهنمایی و رانندگی متوقف شده اید؟ آیا تا به حال در لوله تنفس کرده اید؟ اگر بدشانس هستید، پس یک واکنش اکسیداسیون الکل رخ داد، که در طی آن رنگ تغییر کرد، و باید یک سوال جالب بپردازید. الکل یک بیگانه بیوتیک است - موادی که در بدن انسان یافت نمی شود، اما بر عملکردهای حیاتی آن تأثیر می گذارد. همه چیز به دوز بستگی دارد. 1. الکل یک ماده مغذی است که انرژی بدن را تامین می کند. در قرون وسطی، بدن حدود 25 درصد از انرژی خود را از طریق مصرف الکل دریافت می کرد. 2. الکل دارویی است که دارای اثر ضد عفونی کننده و ضد باکتری است; 3. الکل سمی است که فرآیندهای زیستی طبیعی را مختل می کند، اندام های داخلی و روان را از بین می برد و در صورت مصرف زیاد منجر به مرگ می شود.استفاده از اتانول اتیل الکل در تهیه انواع مشروبات الکلی استفاده می شود. در پزشکی برای تهیه عصاره گیاهان دارویی و همچنین برای ضدعفونی. در لوازم آرایشی و عطرسازی، اتانول حلال عطرها و لوسیون ها است اثرات مضر اتانول در ابتدای مسمومیت، ساختارهای قشر مغز آسیب می بینند. فعالیت مراکز مغزی که رفتار را کنترل می کنند سرکوب می شود: کنترل منطقی بر اعمال از بین می رود و نگرش انتقادی نسبت به خود کاهش می یابد. I. P. Pavlov این وضعیت را "شورش زیر قشر" نامید - با محتوای الکل بسیار زیاد در خون ، فعالیت مراکز حرکتی مغز مهار می شود ، عملکرد مخچه عمدتاً تحت تأثیر قرار می گیرد - فرد کاملاً جهت گیری را از دست می دهد مضر است. اثرات اتانول تغییرات در ساختار مغز ناشی از چندین سال مسمومیت با الکل، تقریباً غیرقابل برگشت است و حتی پس از پرهیز طولانی مدت از نوشیدن الکل، همچنان ادامه دارد. اگر فرد نتواند متوقف شود، انحرافات ارگانیک و در نتیجه ذهنی از هنجار افزایش می یابد.اثرات مضر اتانول الکل تأثیر بسیار نامطلوبی بر رگ های خونی مغز دارد. در ابتدای مسمومیت، گسترش می یابند، جریان خون در آنها کاهش می یابد که منجر به احتقان در مغز می شود. سپس، هنگامی که علاوه بر الکل، محصولات مضر تجزیه ناقص آن در خون انباشته می شوند، اسپاسم شدید رخ می دهد، انقباض عروق رخ می دهد و عوارض خطرناکی مانند سکته مغزی ایجاد می شود که منجر به ناتوانی شدید و حتی مرگ می شود. سوالات برای تجدید نظر 1. 2. 3. 4. 5. 6. 7. 8. یک ظرف بدون برچسب حاوی آب و دیگری حاوی الکل است. آیا می توان از یک نشانگر برای تشخیص آنها استفاده کرد؟ افتخار به دست آوردن الکل خالص متعلق به چه کسی است؟ آیا الکل می تواند جامد باشد؟ وزن مولکولی متانول 32 و دی اکسید کربن 44 است. در مورد وضعیت تجمع الکل نتیجه بگیرید. یک لیتر الکل و یک لیتر آب را با هم مخلوط کنید. حجم مخلوط را تعیین کنید. چگونه بازرس پلیس راهنمایی و رانندگی را فریب دهیم؟ آیا الکل مطلق بدون آب می تواند آب از خود خارج کند؟ بیگانه بیوتیک ها چیست و چگونه با الکل ها ارتباط دارند؟ پاسخ 1. 2. 3. 4. 5. 6. 7. 8. غیرممکن است. شاخص ها بر الکل ها و محلول های آبی آنها تأثیر نمی گذارند. البته کیمیاگران. شاید اگر این الکل حاوی 12 اتم کربن یا بیشتر باشد. از این داده ها هیچ نتیجه ای نمی توان گرفت. پیوندهای هیدروژنی بین مولکول های الکل، با توجه به وزن مولکولی کم این مولکول ها، نقطه جوش الکل را به طور غیر طبیعی بالا می برد. حجم مخلوط دو لیتر نیست، بلکه بسیار کوچکتر است، تقریباً 1 لیتر - 860 میلی لیتر. هنگام رانندگی مشروب نخورید شاید اگر آن را گرم کنید و کانکس اضافه کنید. اسید سولفوریک. تنبل نباشید و همه چیزهایی را که در مورد الکل شنیده اید به خاطر بسپارید، یک بار برای همیشه تصمیم بگیرید که دوز مصرفی شما چقدر است. و اصلا نیاز هست؟؟؟؟ الکل پلی هیدریک اتیلن گلیکول اتیلن گلیکول نماینده الکل های دی هیدریک اشباع - گلیکول ها است. نام گلیکول ها به دلیل طعم شیرین بسیاری از نمایندگان این سری (به یونانی "glycos" - شیرین) داده شد. اتیلن گلیکول مایعی شربتی با طعم شیرین، بی بو و سمی است. به خوبی با آب و الکل مخلوط می شود، کاربرد رطوبت سنجی اتیلن گلیکول یکی از ویژگی های مهم اتیلن گلیکول توانایی پایین آوردن نقطه انجماد آب است، به همین دلیل است که این ماده به طور گسترده به عنوان جزء ضد یخ خودرو و مایعات ضد یخ استفاده می شود. برای تولید لاوسان (الیاف مصنوعی با ارزش) استفاده می شود. اتیلن گلیکول یک سم است دوزهای ایجاد کننده مسمومیت کشنده با اتیلن گلیکول بسیار متفاوت است - از 100 تا 600 میلی لیتر. به گفته تعدادی از نویسندگان، دوز کشنده برای انسان 50-150 میلی لیتر است. میزان مرگ و میر ناشی از اتیلن گلیکول بسیار بالاست و بیش از 60 درصد از کل موارد مسمومیت را تشکیل می دهد. مکانیسم اثر سمی اتیلن گلیکول تا به امروز به اندازه کافی مورد مطالعه قرار نگرفته است. اتیلن گلیکول به سرعت جذب می شود (از جمله از طریق منافذ پوست) و به مدت چندین ساعت بدون تغییر در خون گردش می کند و پس از 2-5 ساعت به حداکثر غلظت خود می رسد. سپس محتوای آن در خون به تدریج کاهش می یابد و در بافت ها ثابت می شود. مایع بی رنگ، چسبناک، جاذب رطوبت، با طعم شیرین. قابل اختلاط با آب به هر نسبت، حلال خوبی است. با اسید نیتریک واکنش نشان می دهد و نیتروگلیسیرین را تشکیل می دهد. با اسیدهای کربوکسیلیک چربی و روغن تشکیل می دهد. CH2 – CH – CH2 OH OH OH کاربردهای گلیسیرین هنگام پردازش چرم؛ به عنوان جزء برخی از چسب ها؛ در تولید پلاستیک از گلیسیرین به عنوان نرم کننده استفاده می شود. در تولید شیرینی ها و نوشیدنی ها (به عنوان یک افزودنی غذایی E422) واکنش کیفی به الکل های پلی هیدریک واکنش کیفی به الکل های پلی هیدریک واکنش به الکل های پلی هیدریک برهمکنش آنها با یک رسوب تازه به دست آمده از هیدروکسید مس (II) است که حل می شود و تشکیل می دهد. راه حل آبی-بنفش روشن وظایف کارت کار درس را پر کنید. به سوالات آزمون پاسخ دهید؛ حل جدول کلمات متقاطع کاربرگ درس "الکل ها" فرمول کلی الکل ها مواد را نام ببرید: CH3OH CH3-CH2-CH2-CH2-OH CH2(OH)-CH2(OH) فرمول ساختاری پروپانول-2 تعریف اتمی الکل چیست؟ موارد کاربرد اتانول را فهرست کنید از چه الکل هایی در صنایع غذایی استفاده می شود؟ چه الکلی با ورود 30 میلی لیتر به بدن باعث مسمومیت کشنده می شود؟ چه ماده ای به عنوان مایع ضد یخ استفاده می شود؟ چگونه الکل پلی هیدریک را از الکل مونوهیدریک تشخیص دهیم؟ روش های تهیه آزمایشگاهی هیدرولیز هالوآلکان ها: R-CL+NaOH R-OH+NaCL هیدراتاسیون آلکن ها: CH2=CH2+H2O C2H5OH هیدروژناسیون ترکیبات کربونیل صنعتی سنتز متانول از سنتز CH3-2H2 فشار بالا، دمای بالا و کاتالیزور اکسید روی) هیدراتاسیون آلکن ها تخمیر گلوکز: C6H12O6 2C2H5OH+2CO2 خواص شیمیایی 1. واکنش های با گسیختگی پیوند RO-H الکل ها با فلزات قلیایی خاکی و قلیایی واکنش می دهند. ترکیبات - الکلات 2СH CH CH OH + 2Na 2CH CH CH ONa + H 2CH CH OH + Ca (CH CH O) Ca + H 3 2 3 2 2 3 3 2 2 2 2 2 2 2 تعامل با اسیدهای آلی (واکنش استری شدن) منجر به تشکیل استرها می شود. CH COOH + HOC H CH COOC H (اتیل استات (اتیل استات)) + H O 3 2 5 3 2 5 2 II. واکنش های شامل شکستن پیوند R-OH با هالیدهای هیدروژن: R-OH + HBr R-Br + H2O III. واکنش های اکسیداسیون الکل ها می سوزند: 2С3H7ОH + 9O2 6СO2 + 8H2O تحت اثر عوامل اکسید کننده: الکل های اولیه به آلدئید، الکل های ثانویه به کتون IV تبدیل می شوند. کم آبی زمانی رخ می دهد که با معرف های حذف کننده آب گرم شود (H2SO4 conc.). 1. کم آبی درون مولکولی منجر به تشکیل آلکن های CH3-CH2-OH CH2=CH2 + H2O 2. کم آبی بین مولکولی به اترها R-OH + H-O-R R-O-R(اتر) + H2O می دهد.
همه مواد می توانند در حالت های مختلف تجمع باشند - جامد، مایع، گاز و پلاسما. در زمان های قدیم اعتقاد بر این بود که جهان از خاک، آب، هوا و آتش تشکیل شده است. حالات مجموع مواد با این تقسیم بصری مطابقت دارد. تجربه نشان می دهد که مرزهای بین حالت های تجمع بسیار دلخواه است. گازها در فشارهای پایین و دماهای پایین ایده آل در نظر گرفته می شوند؛ مولکول های موجود در آنها با نقاط مادی مطابقت دارند که فقط طبق قوانین برخورد الاستیک می توانند با هم برخورد کنند. نیروهای برهمکنش بین مولکول ها در لحظه برخورد ناچیز است و خود برخورد بدون از دست دادن انرژی مکانیکی رخ می دهد. اما با افزایش فاصله بین مولکول ها، برهمکنش مولکول ها نیز باید در نظر گرفته شود. این فعل و انفعالات شروع به تأثیرگذاری بر انتقال از حالت گازی به مایع یا جامد می کنند. انواع مختلفی از برهمکنش ها می تواند بین مولکول ها رخ دهد.
نیروهای برهمکنش بین مولکولی قابل اشباع نیستند و با نیروهای برهمکنش شیمیایی اتم ها متفاوت است و منجر به تشکیل مولکول ها می شود. آنها می توانند به دلیل برهمکنش بین ذرات باردار الکترواستاتیک باشند. تجربه نشان داده است که برهمکنش مکانیکی کوانتومی، که به فاصله و جهت گیری متقابل مولکول ها بستگی دارد، در فواصل بین مولکول های بیش از 9-10 متر قابل اغماض است. عملا برابر با صفر است. در فواصل کوتاه این انرژی کم است و نیروهای جذاب متقابل عمل می کنند
در - دافعه و نیروی متقابل
جاذبه و دافعه مولکول ها متعادل است و F= 0. در اینجا نیروها از طریق ارتباط آنها با انرژی پتانسیل تعیین می شود، اما ذرات حرکت می کنند و دارای ذخیره خاصی از انرژی جنبشی هستند.
gii. بگذارید یک مولکول بی حرکت باشد و دیگری با داشتن چنین منبع انرژی با آن برخورد کند. با نزدیک شدن مولکول ها به یکدیگر، نیروهای جاذبه کار مثبت انجام می دهند و انرژی پتانسیل برهمکنش آنها تا فاصله ای کاهش می یابد و در عین حال انرژی جنبشی (و سرعت) افزایش می یابد. هنگامی که فاصله کمتر شود، نیروهای جاذبه با نیروهای دافعه جایگزین می شوند. کار انجام شده توسط مولکول در برابر این نیروها منفی است.
مولکول تا زمانی که انرژی جنبشی آن به طور کامل به پتانسیل تبدیل شود به یک مولکول ساکن نزدیکتر می شود. حداقل فاصله د،فاصله ای که مولکول ها می توانند در آن نزدیک شوند نامیده می شود قطر موثر مولکولپس از توقف، مولکول تحت تأثیر نیروهای دافعه با افزایش سرعت شروع به دور شدن می کند. پس از گذراندن مجدد مسافت، مولکول به منطقه نیروهای جاذبه می افتد که سرعت حذف آن را کاهش می دهد. قطر موثر به ذخیره اولیه انرژی جنبشی بستگی دارد، یعنی. این مقدار ثابت نیست در فواصل مساوی، انرژی پتانسیل برهمکنش دارای یک مقدار بی نهایت بزرگ یا یک "موانع" است که از نزدیک شدن مراکز مولکول ها به فاصله کمتری جلوگیری می کند. نسبت میانگین انرژی برهمکنش پتانسیل به میانگین انرژی جنبشی وضعیت تجمع یک ماده را تعیین می کند: برای گازها، برای مایعات، برای جامدات.
ماده متراکم شامل مایعات و جامدات است. در آنها، اتم ها و مولکول ها نزدیک و تقریباً لمس کننده قرار دارند. میانگین فاصله بین مراکز مولکول ها در مایعات و جامدات در حد (2-5) 10-10 متر است و چگالی آنها نیز تقریباً یکسان است. فواصل بین اتمی بیشتر از فواصلی است که ابرهای الکترونی به یکدیگر نفوذ می کنند، به طوری که نیروهای دافعه ایجاد می شود. برای مقایسه، در گازها در شرایط عادی میانگین فاصله بین مولکول ها حدود 33 10-10 متر است.
که در مایعاتبرهمکنش بین مولکولی اثر قوی تری دارد، حرکت حرارتی مولکول ها خود را در ارتعاشات ضعیف در اطراف موقعیت تعادل نشان می دهد و حتی از یک موقعیت به موقعیت دیگر می پرد. بنابراین، آنها فقط در چینش ذرات دارای نظم کوتاه برد، یعنی ثبات در آرایش تنها نزدیکترین ذرات و سیالیت مشخصه هستند.
مواد جامدآنها با استحکام ساختاری مشخص می شوند، حجم و شکل دقیقاً مشخصی دارند که تحت تأثیر دما و فشار بسیار کمتر تغییر می کنند. در جامدات، حالت های آمورف و کریستالی امکان پذیر است. مواد واسطه ای نیز وجود دارد - کریستال های مایع. اما اتم ها در جامدات آنطور که ممکن است تصور شود اصلاً ساکن نیستند. هر یک از آنها تحت تأثیر نیروهای الاستیکی که بین همسایگان خود ایجاد می شود همیشه در نوسان است. اکثر عناصر و ترکیبات ساختار بلوری زیر میکروسکوپ دارند.
بنابراین، دانه های نمک سفره مانند مکعب های کامل به نظر می رسند. در کریستالها، اتمها در محلهای شبکه بلوری ثابت هستند و فقط در نزدیکی محلهای شبکه میتوانند ارتعاش کنند. کریستال ها جامدات واقعی را تشکیل می دهند و جامداتی مانند پلاستیک یا آسفالت جایگاه میانی بین جامدات و مایعات را اشغال می کنند. جسم آمورف مانند مایع دارای نظم کوتاه برد است اما احتمال پرش کم است. بنابراین، شیشه را می توان به عنوان یک مایع فوق خنک با افزایش ویسکوزیته در نظر گرفت. کریستال های مایع سیالیت مایعات را دارند، اما آرایش منظم اتم ها را حفظ می کنند و خواص ناهمسانگردی دارند.
پیوندهای شیمیایی اتم ها (و تقریباً در) در کریستال ها مانند مولکول ها است. ساختار و سفتی جامدات با تفاوت در نیروهای الکترواستاتیکی که اتمهای سازنده بدن را به هم متصل میکنند، تعیین میشود. مکانیسمی که اتم ها را به مولکول ها متصل می کند می تواند منجر به تشکیل ساختارهای تناوبی جامد شود که می توانند به عنوان ماکرومولکول در نظر گرفته شوند. مانند مولکول های یونی و کووالانسی، کریستال های یونی و کووالانسی نیز وجود دارد. شبکه های یونی در کریستال ها توسط پیوندهای یونی به هم متصل می شوند (شکل 7.1 را ببینید). ساختار نمک خوراکی به گونه ای است که هر یون سدیم شش همسایه دارد - یون کلر. این توزیع مربوط به حداقل انرژی است، یعنی زمانی که چنین پیکربندی شکل می گیرد، حداکثر انرژی آزاد می شود. بنابراین، با کاهش دما به زیر نقطه ذوب، تمایل به تشکیل کریستال های خالص وجود دارد. با افزایش دما، انرژی جنبشی حرارتی برای شکستن پیوند کافی است، کریستال شروع به ذوب شدن می کند و ساختار شروع به فروپاشی می کند. پلی مورفیسم کریستالی توانایی تشکیل حالت هایی با ساختارهای کریستالی مختلف است.
هنگامی که توزیع بار الکتریکی در اتم های خنثی تغییر می کند، برهمکنش ضعیف بین همسایگان می تواند رخ دهد. این پیوند مولکولی یا واندروالس (مانند یک مولکول هیدروژن) نامیده می شود. اما نیروهای جاذبه الکترواستاتیکی نیز میتوانند بین اتمهای خنثی به وجود بیایند، سپس هیچ تغییری در پوستههای الکترونیکی اتمها رخ نمیدهد. دافعه متقابل با نزدیک شدن لایه های الکترونی به یکدیگر، مرکز ثقل بارهای منفی را نسبت به بارهای مثبت تغییر می دهد. هر یک از اتم ها یک دوقطبی الکتریکی را در دیگری القا می کند و این منجر به جذب آنها می شود. این عمل نیروهای بین مولکولی یا نیروهای واندروالس است که شعاع عمل زیادی دارند.
از آنجایی که یک اتم هیدروژن بسیار کوچک است و الکترون آن به راحتی قابل جابجایی است، اغلب به دو اتم در آن واحد جذب می شود و یک پیوند هیدروژنی تشکیل می دهد. پیوند هیدروژنی نیز مسئول برهمکنش مولکول های آب با یکدیگر است. بسیاری از خواص منحصر به فرد آب و یخ را توضیح می دهد (شکل 7.4).
پیوند کووالانسی(یا اتمی) به دلیل تعامل داخلی اتم های خنثی به دست می آید. نمونه ای از چنین پیوندی، پیوند موجود در مولکول متان است. نوع کربن با پیوند بالا الماس است (چهار اتم هیدروژن با چهار اتم کربن جایگزین می شود).
بنابراین، کربن که بر روی یک پیوند کووالانسی ساخته شده است، کریستالی به شکل الماس را تشکیل می دهد. هر اتم توسط چهار اتم احاطه شده است که یک چهار وجهی منظم را تشکیل می دهد. اما هر یک از آنها راس چهار وجهی همسایه نیز هستند. در شرایط دیگر، همان اتمهای کربن متبلور میشوند گرافیتدر گرافیت نیز با پیوندهای اتمی به هم متصل می شوند، اما صفحاتی از سلول های لانه زنبوری شش ضلعی را تشکیل می دهند که قادر به برش هستند. فاصله بین اتم های واقع در راس شش وجهی 0.142 نانومتر است. لایه ها در فاصله 0.335 نانومتر قرار دارند، یعنی. پیوند ضعیفی دارند، بنابراین گرافیت پلاستیکی و نرم است (شکل 7.5). در سال 1990، رونق تحقیقات ناشی از اعلام کشف یک ماده جدید - فولریت،متشکل از مولکول های کربن - فولرن ها. این شکل از کربن مولکولی است، یعنی. حداقل عنصر یک اتم نیست، بلکه یک مولکول است. این بنا به افتخار معمار آر. فولر، که در سال 1954 حق اختراع ساخت سازه های ساخته شده از شش ضلعی و پنج ضلعی که یک نیمکره را تشکیل می دهند، دریافت کرد. مولکول از 60 اتم های کربن با قطر 0.71 نانومتر در سال 1985 کشف شد، سپس مولکول ها و غیره کشف شد. همه آنها سطوح ثابتی داشتند،
اما پایدارترین مولکولها C 60 و با 70 . منطقی است که فرض کنیم از گرافیت به عنوان ماده اولیه برای سنتز فولرن ها استفاده می شود. اگر اینطور باشد، شعاع قطعه شش ضلعی باید 0.37 نانومتر باشد. اما معلوم شد که برابر با 0.357 نانومتر است. این تفاوت 2 درصدی به این دلیل است که اتمهای کربن روی یک سطح کروی در راس 20 ششضلعی منظم که از گرافیت به ارث رسیدهاند و 12 پنجضلعی منظم، یعنی قرار دارند. طراحی شبیه توپ فوتبال است. معلوم می شود که وقتی به یک کره بسته "دوخته می شود"، برخی از شش وجهی های مسطح تبدیل به پنج وجهی می شوند. در دمای اتاق، مولکول های C60 به ساختاری متراکم می شوند که در آن هر مولکول دارای 12 همسایه است که با فاصله 0.3 نانومتر از هم فاصله دارند. در تی= 349 K، یک انتقال فاز مرتبه اول رخ می دهد - شبکه به یک مکعب بازآرایی می شود. کریستال به خودی خود یک نیمه رسانا است، اما هنگامی که یک فلز قلیایی به فیلم کریستالی C 60 اضافه می شود، ابررسانایی در دمای 19 کلوین رخ می دهد. اگر یک یا آن اتم به این مولکول توخالی وارد شود، می توان از آن به عنوان پایه ای برای ایجاد یک رسانه ذخیره سازی با تراکم اطلاعات فوق العاده بالا: تراکم ضبط به 4-10 12 بیت بر سانتی متر مربع می رسد. برای مقایسه، یک فیلم از مواد فرومغناطیسی چگالی ضبط مرتبه 10 7 بیت بر سانتی متر مربع، و دیسک های نوری، یعنی. تکنولوژی لیزر، - 10 8 بیت بر سانتی متر مربع. این کربن خواص منحصر به فرد دیگری نیز دارد که به ویژه در پزشکی و فارماکولوژی اهمیت دارد.
خود را در کریستال های فلزی نشان می دهد اتصال فلزی،وقتی همه اتمهای یک فلز، الکترونهای ظرفیت خود را «برای استفاده جمعی» رها میکنند. آنها ضعیف به اسکلت های اتمی متصل هستند و می توانند آزادانه در امتداد شبکه کریستالی حرکت کنند. حدود 2/5 از عناصر شیمیایی فلزات هستند. در فلزات (به جز جیوه)، زمانی که اوربیتال های خالی اتم های فلزی روی هم قرار می گیرند و الکترون ها به دلیل تشکیل شبکه کریستالی حذف می شوند، پیوند ایجاد می شود. به نظر می رسد که کاتیون های شبکه در گاز الکترون احاطه شده اند. پیوند فلزی زمانی اتفاق می افتد که اتم ها در فاصله ای کوچکتر از اندازه ابر الکترون های بیرونی به هم می رسند. با این پیکربندی (اصل پائولی)، انرژی الکترونهای بیرونی افزایش مییابد، و هستههای همسایه شروع به جذب این الکترونهای بیرونی میکنند، ابرهای الکترونی را تار میکنند، آنها را به طور مساوی در سراسر فلز توزیع میکنند و به گاز الکترونی تبدیل میکنند. به این ترتیب الکترون های رسانایی به وجود می آیند که رسانایی الکتریکی بالای فلزات را توضیح می دهند. در بلورهای یونی و کووالانسی، الکترون های بیرونی عملاً به هم متصل هستند و رسانایی این جامدات بسیار کم است، به آنها می گویند. عایق ها
انرژی درونی مایعات با مجموع انرژی های درونی زیرسیستم های ماکروسکوپی که می توان آن را از نظر ذهنی به آنها تقسیم کرد و انرژی های تعامل این زیرسیستم ها تعیین می شود. برهمکنش از طریق نیروهای مولکولی با شعاع عمل در حد 9-10 متر انجام می شود. برای ماکروسیستم ها، انرژی برهمکنش متناسب با سطح تماس است، بنابراین مانند کسر لایه سطحی کوچک است، اما این ضروری نیست. انرژی سطحی نامیده می شود و باید در مسائل مربوط به کشش سطحی مورد توجه قرار گیرد. به طور معمول، مایعات حجم بیشتری را با وزن مساوی اشغال می کنند، یعنی چگالی کمتری دارند. اما چرا حجم یخ و بیسموت در حین ذوب کاهش می یابد و حتی پس از نقطه ذوب نیز تا مدتی این روند را حفظ می کند؟ به نظر می رسد که این مواد در حالت مایع متراکم تر هستند.
در یک مایع، هر اتم توسط همسایگانش اثر میگذارد، و در داخل چاه پتانسیل ناهمسانگردی که آنها ایجاد میکنند، نوسان میکند. برخلاف جسم جامد، این سوراخ کم عمق است، زیرا همسایگان دور تقریباً هیچ تأثیری ندارند. محیط بلافصل ذرات در مایع تغییر می کند، یعنی مایع جریان می یابد. وقتی به دمای معینی رسید، مایع به جوش میآید و در هنگام جوشیدن، دما ثابت میماند. انرژی دریافتی صرف شکستن پیوندها می شود و مایع پس از شکسته شدن کامل به گاز تبدیل می شود.
چگالی مایعات بسیار بیشتر از چگالی گازها در فشارها و دماهای یکسان است. بنابراین، حجم آب در زمان جوش تنها 1/1600 حجم همان جرم بخار آب است. حجم مایع بستگی کمی به فشار و دما دارد. در شرایط عادی (20 درجه سانتیگراد و فشار 1.013 10 5 Pa)، آب حجمی معادل 1 لیتر را اشغال می کند. هنگامی که دما به 10 درجه سانتیگراد کاهش می یابد، حجم فقط 0.0021 کاهش می یابد و هنگامی که فشار افزایش می یابد، حجم به نصف کاهش می یابد.
اگرچه هنوز مدل ایده آل ساده ای از یک مایع وجود ندارد، ریزساختار آن به اندازه کافی مورد مطالعه قرار گرفته است و توضیح کیفی بسیاری از خواص ماکروسکوپی آن را ممکن می سازد. گالیله به این واقعیت اشاره کرد که در مایعات انسجام مولکول ها ضعیف تر از جسم جامد است. او تعجب کرد که قطرات بزرگ آب روی برگ کلم جمع شده و روی برگ پخش نشده است. جیوه یا قطرات آب ریخته شده روی سطحی چرب به دلیل چسبندگی به شکل گلوله های کوچک در می آید. اگر مولکول های یک ماده به مولکول های یک ماده دیگر جذب شوند، ما از آن صحبت می کنیم خیس شدن،به عنوان مثال چسب و چوب، روغن و فلز (با وجود فشار زیاد، روغن در یاتاقان ها حفظ می شود). اما آب در لوله های نازکی به نام مویرگ ها بالا می رود و هر چه لوله نازکتر باشد بالاتر می رود. هیچ توضیح دیگری جز اثر خیس شدن آب و لیوان نمی تواند داشته باشد. نیروهای خیس کردن بین شیشه و آب بیشتر از بین مولکول های آب است. با جیوه، اثر برعکس است: خیس شدن جیوه و شیشه ضعیف تر از نیروهای چسبندگی بین اتم های جیوه است. گالیله متوجه شد که یک سوزن روغن کاری شده با چربی می تواند روی آب شناور باشد، اگرچه این با قانون ارشمیدس در تضاد بود. وقتی سوزن شناور شد، می توانید
اما به انحراف جزئی سطح آب توجه کنید و سعی کنید به طور معمول صاف شود. نیروهای چسبندگی بین مولکول های آب برای جلوگیری از افتادن سوزن در آب کافی است. لایه سطحی مانند یک فیلم از آب محافظت می کند کشش سطحی،که تمایل دارد به شکل آب کوچکترین سطح - کروی را بدهد. اما سوزن دیگر روی سطح الکل شناور نخواهد بود، زیرا وقتی الکل به آب اضافه می شود، کشش سطحی کاهش می یابد و سوزن فرو می رود. صابون همچنین کشش سطحی را کاهش میدهد، بنابراین کف صابونی داغ که به شکافها و شکافها نفوذ میکند، کثیفیها، بهویژه آنهایی که حاوی چربی هستند را بهتر میشوید، در حالی که آب تمیز به سادگی به صورت قطرات پیچیده میشود.
پلاسما حالت چهارم ماده است که گازی است که از مجموعه ای از ذرات باردار تشکیل شده است که در فواصل طولانی برهم کنش دارند. در این حالت، تعداد بارهای مثبت و منفی تقریباً برابر است، به طوری که پلاسما از نظر الکتریکی خنثی است. از میان چهار عنصر، پلاسما مربوط به آتش است. برای تبدیل یک گاز به حالت پلاسما، باید باشد یونیزه کردن،حذف الکترون ها از اتم ها یونیزاسیون را می توان با گرم کردن، تخلیه الکتریکی یا تشعشع سخت انجام داد. ماده در کیهان عمدتاً در حالت یونیزه است. در ستارگان، یونیزه شدن به صورت حرارتی، در سحابی های نادر و گاز بین ستاره ای - توسط تابش فرابنفش از ستاره ها ایجاد می شود. خورشید ما نیز از پلاسما تشکیل شده است که تابش آن لایههای بالایی جو زمین را یونیزه میکند. یون کره،امکان ارتباط رادیویی از راه دور به شرایط آن بستگی دارد. در شرایط زمینی، پلاسما به ندرت یافت می شود - در لامپ های فلورسنت یا در قوس الکتریکی جوشکاری. در آزمایشگاه ها و فناوری، پلاسما اغلب از طریق تخلیه الکتریکی به دست می آید. در طبیعت، رعد و برق این کار را انجام می دهد. در طول یونیزاسیون توسط تخلیه، بهمن های الکترونی شبیه به فرآیند واکنش زنجیره ای رخ می دهد. برای به دست آوردن انرژی گرما هسته ای، از روش تزریق استفاده می شود: یون های گازی که با سرعت های بسیار بالا شتاب می گیرند به تله های مغناطیسی تزریق می شوند، الکترون ها را از محیط جذب می کنند و پلاسما را تشکیل می دهند. یونیزاسیون فشار - امواج ضربه ای - نیز استفاده می شود. این روش یونیزاسیون در ستارگان فوق چگال و احتمالاً در هسته زمین اتفاق می افتد.
هر نیرویی که بر یون ها و الکترون ها وارد شود باعث ایجاد جریان الکتریکی می شود. اگر با میدان های خارجی جفت نشود و در داخل پلاسما بسته نشود، قطبی می شود. پلاسما از قوانین گاز تبعیت می کند، اما زمانی که یک میدان مغناطیسی اعمال می شود، که حرکت ذرات باردار را تنظیم می کند، خواصی از خود نشان می دهد که برای یک گاز کاملاً غیرعادی است. در یک میدان مغناطیسی قوی، ذرات شروع به چرخش در اطراف خطوط میدان می کنند و آزادانه در امتداد میدان مغناطیسی حرکت می کنند. آنها می گویند که این حرکت مارپیچ ساختار خطوط میدان را تغییر می دهد و میدان در پلاسما "یخ زده" می شود. پلاسمای کمیاب توسط سیستمی از ذرات توصیف می شود، در حالی که پلاسمای متراکم تر توسط یک مدل مایع توصیف می شود.
رسانایی الکتریکی بالای پلاسما تفاوت اصلی آن با گاز است. رسانایی پلاسمای سرد سطح خورشید (0.8 10 -19 J) به رسانایی فلزات می رسد و در دمای گرما هسته ای (1.6 10-15 J) پلاسمای هیدروژن 20 برابر بهتر از مس در شرایط عادی جریان را هدایت می کند. از آنجایی که پلاسما قادر به هدایت جریان است، مدل مایع رسانا اغلب برای آن اعمال می شود. این یک محیط پیوسته در نظر گرفته می شود، اگرچه تراکم پذیری آن را از مایع معمولی متمایز می کند، اما این تفاوت فقط در جریان هایی که سرعت آنها بیشتر از سرعت صوت است ظاهر می شود. رفتار یک سیال رسانا در علمی به نام هیدرودینامیک مغناطیسیدر فضا، هر پلاسما یک رسانای ایده آل است و قوانین میدان یخ زده کاربرد گسترده ای دارند. مدل یک مایع رسانا به ما امکان می دهد مکانیسم محصور شدن پلاسما توسط یک میدان مغناطیسی را درک کنیم. بنابراین، جریان های پلاسما از خورشید ساطع می شوند و جو زمین را تحت تأثیر قرار می دهند. خود جریان میدان مغناطیسی ندارد، اما طبق قانون انجماد، میدان خارجی نمی تواند به درون آن نفوذ کند. جریان های خورشیدی پلاسما میدان های مغناطیسی بین سیاره ای خارجی را از مجاورت خورشید بیرون می راند. در جایی که میدان ضعیف تر است، یک حفره مغناطیسی ظاهر می شود. هنگامی که این جریان های پلاسمایی جسمی به زمین نزدیک می شوند، با میدان مغناطیسی زمین برخورد می کنند و طبق همان قانون مجبور می شوند در اطراف آن جریان پیدا کنند. معلوم می شود که نوعی حفره است که در آن میدان مغناطیسی جمع می شود و جریان های پلاسما در آن نفوذ نمی کنند. ذرات باردار که توسط موشک ها و ماهواره ها شناسایی شده اند روی سطح آن جمع می شوند - این کمربند تشعشع بیرونی زمین است. این ایده ها همچنین در حل مشکلات محصور شدن پلاسما توسط یک میدان مغناطیسی در دستگاه های خاص - توکامک (از مخفف کلمات: محفظه حلقوی، آهنربا) استفاده شد. با وجود پلاسمای کاملاً یونیزه شده در این سیستمها و سایر سیستمها، امید به دستیابی به یک واکنش گرما هستهای کنترلشده در زمین است. این یک منبع انرژی پاک و ارزان (آب دریا) را فراهم می کند. همچنین کار برای تولید و حفظ پلاسما با استفاده از تابش لیزر متمرکز در حال انجام است.
سخنرانی 4. حالات مجموع ماده
1. حالت جامد ماده.
2. حالت مایع ماده.
3. حالت گازی ماده.
مواد می توانند در سه حالت تجمع باشند: جامد، مایع و گاز. در دماهای بسیار بالا، نوعی حالت گازی ظاهر می شود - پلاسما (حالت پلاسما).
1. حالت جامد ماده با این واقعیت مشخص می شود که انرژی برهمکنش بین ذرات از انرژی جنبشی حرکت آنها بیشتر است. اکثر مواد در حالت جامد دارای ساختار کریستالی هستند. هر ماده بلورهایی با شکل خاصی را تشکیل می دهد. به عنوان مثال، کلرید سدیم دارای کریستال هایی به شکل مکعب، زاج به شکل هشت وجهی و نیترات سدیم به شکل منشور است.
شکل کریستالی این ماده پایدارترین است. آرایش ذرات در یک جامد به شکل یک شبکه به تصویر کشیده شده است که در گره های آن ذرات خاصی با خطوط خیالی به هم متصل شده اند. چهار نوع اصلی شبکه کریستالی وجود دارد: اتمی، مولکولی، یونی و فلزی.
شبکه کریستالی اتمیتشکیل شده توسط اتم های خنثی که توسط پیوندهای کووالانسی (الماس، گرافیت، سیلیکون) به هم متصل شده اند. شبکه کریستالی مولکولینفتالین، ساکارز، گلوکز دارند. عناصر ساختاری این شبکه مولکول های قطبی و غیرقطبی هستند. شبکه کریستالی یونیتوسط یون های دارای بار مثبت و منفی (کلرید سدیم، کلرید پتاسیم) که به طور منظم در فضا به صورت متناوب در حال تغییر هستند، تشکیل می شوند. همه فلزات دارای یک شبکه کریستالی فلزی هستند. گره های آن حاوی یون هایی با بار مثبت هستند که بین آنها الکترون هایی در حالت آزاد وجود دارد.
مواد کریستالی دارای تعدادی ویژگی هستند. یکی از آنها ناهمسانگردی است - عدم تشابه خواص فیزیکی یک کریستال در جهات مختلف در داخل کریستال.
2. در حالت مایع ماده، انرژی برهمکنش بین مولکولی ذرات با انرژی جنبشی حرکت آنها متناسب است. این حالت حد واسط بین گازی و کریستالی است. بر خلاف گازها، نیروهای زیادی از جاذبه متقابل بین مولکول های مایع عمل می کنند که ماهیت حرکت مولکولی را تعیین می کند. حرکت حرارتی یک مولکول مایع شامل ارتعاش و انتقال است. هر مولکول برای مدتی حول نقطه تعادل خاصی نوسان می کند و سپس حرکت می کند و دوباره موقعیت تعادلی می گیرد. این سیال بودن آن را تعیین می کند. نیروهای جاذبه بین مولکولی مانع از حرکت مولکول ها از یکدیگر در هنگام حرکت می شود.
خواص مایعات به حجم مولکول ها و شکل سطح آنها نیز بستگی دارد. اگر مولکول های مایع قطبی باشند، آنگاه با هم ترکیب می شوند و به یک کمپلکس پیچیده تبدیل می شوند. چنین مایعاتی همراه (آب، استون، الکل) نامیده می شوند. Oʜᴎ دارای t kip بالاتر، فراریت کمتر و ثابت دی الکتریک بالاتر است.
همانطور که می دانید مایعات کشش سطحی دارند. کشش سطحی- ϶ᴛᴏ انرژی سطح در واحد سطح: ϭ = E/S، که ϭ کشش سطحی است. E – انرژی سطحی؛ S – مساحت سطح. هرچه پیوندهای بین مولکولی در یک مایع قوی تر باشد، کشش سطحی آن بیشتر است. موادی که کشش سطحی را کاهش می دهند سورفکتانت نامیده می شوند.
خاصیت دیگر مایعات ویسکوزیته است. ویسکوزیته مقاومتی است که زمانی رخ می دهد که برخی از لایه های یک مایع نسبت به بقیه در هنگام حرکت حرکت می کنند. برخی از مایعات دارای ویسکوزیته بالا (عسل، مالا) هستند، در حالی که برخی دیگر دارای ویسکوزیته پایین (آب، الکل اتیلیک) هستند.
3. در حالت گازی یک ماده، انرژی برهمکنش بین مولکولی ذرات کمتر از انرژی جنبشی آنهاست. به همین دلیل، مولکول های گاز در کنار هم قرار نمی گیرند، بلکه آزادانه در حجم حرکت می کنند. گازها با ویژگی های زیر مشخص می شوند: 1) توزیع یکنواخت در کل حجم ظرفی که در آن قرار دارند. 2) چگالی کم در مقایسه با مایعات و جامدات. 3) تراکم پذیری آسان
در یک گاز، مولکول ها در فاصله بسیار زیادی از یکدیگر قرار دارند، نیروهای جاذبه بین آنها کم است. در فواصل زیاد بین مولکول ها، این نیروها عملاً وجود ندارند. گاز در این حالت معمولاً ایده آل نامیده می شود. گازهای واقعی در فشارهای بالا و دماهای پایین از معادله حالت یک گاز ایده آل (معادله مندلیف-کلاپیرون) تبعیت نمی کنند، زیرا در این شرایط نیروهای برهمکنش بین مولکول ها ظاهر می شوند.
ارائه با موضوع "الکل ها" در شیمی در قالب پاورپوینت. ارائه برای دانش آموزان مدرسه شامل 12 اسلاید است که از دیدگاه شیمیایی در مورد الکل ها، خواص فیزیکی آنها و واکنش با هالیدهای هیدروژن صحبت می کند.
قطعاتی از ارائه
از تاریخ
آیا می دانستید که در قرن چهارم. قبل از میلاد مسیح ه. آیا مردم می دانستند چگونه نوشیدنی های حاوی الکل اتیلیک درست کنند؟ شراب از تخمیر آب میوه و توت تولید می شد. با این حال، آنها خیلی دیرتر یاد گرفتند که جزء مست کننده را از آن استخراج کنند. در قرن یازدهم کیمیاگران بخارهای یک ماده فرار را شناسایی کردند که هنگام گرم شدن شراب آزاد می شد.
مشخصات فیزیکی
- الکل های پایین مایعاتی هستند که در آب بسیار محلول، بی رنگ و بی بو هستند.
- الکل های بالاتر مواد جامدی هستند که در آب نامحلول هستند.
ویژگی خواص فیزیکی: حالت تجمع
- متیل الکل (اولین نماینده سری همولوگ الکل ها) مایع است. شاید وزن مولکولی بالایی داشته باشد؟ خیر بسیار کمتر از دی اکسید کربن. بعدش چیه؟
- به نظر می رسد که کل موضوع در پیوندهای هیدروژنی است که بین مولکول های الکل ایجاد می شود و از پرواز تک تک مولکول ها جلوگیری می کند.
ویژگی خواص فیزیکی: حلالیت در آب
- الکل های پایین در آب محلول هستند، الکل های بالاتر نامحلول هستند. چرا؟
- پیوندهای هیدروژنی برای نگه داشتن مولکول الکل که بخش نامحلول زیادی دارد بین مولکول های آب بسیار ضعیف است.
ویژگی خواص فیزیکی: انقباض
- چرا مردم هنگام حل مسائل محاسباتی هرگز از حجم استفاده نمی کنند، بلکه فقط از جرم استفاده می کنند؟
- 500 میلی لیتر الکل و 500 میلی لیتر آب را مخلوط کنید. ما 930 میلی لیتر محلول دریافت می کنیم. پیوندهای هیدروژنی بین مولکول های الکل و آب به قدری قوی است که حجم کل محلول کاهش می یابد، "فشرده سازی" آن (از لاتین contraktio - فشرده سازی).
آیا الکل ها اسید هستند؟
- الکل ها با فلزات قلیایی واکنش می دهند. در این حالت، اتم هیدروژن گروه هیدروکسیل با یک فلز جایگزین می شود. شبیه اسیده
- اما خواص اسیدی الکل ها بسیار ضعیف است، به طوری که الکل ها بر شاخص ها تأثیر نمی گذارند.
دوستی با پلیس راهنمایی و رانندگی
- آیا مشروبات الکلی با پلیس راهنمایی و رانندگی دوستی دارند؟ اما چگونه!
- آیا تا به حال توسط بازرس پلیس راهنمایی و رانندگی متوقف شده اید؟ آیا تا به حال در لوله تنفس کرده اید؟
- اگر بدشانس بودید، الکل تحت واکنش اکسیداسیون قرار می گرفت و باعث تغییر رنگ می شد و باید جریمه می پرداختید.
آب می دهیم 1
حذف آب - اگر دما بیش از 140 درجه باشد، کم آبی می تواند درون مولکولی باشد. این به یک کاتالیزور - اسید سولفوریک غلیظ نیاز دارد.
آب پس بده 2
اگر دما کاهش یابد و کاتالیزور ثابت بماند، آبگیری بین مولکولی رخ می دهد.
واکنش با هالیدهای هیدروژن
این واکنش برگشت پذیر است و به یک کاتالیزور - اسید سولفوریک غلیظ نیاز دارد.
دوست بودن یا نبودن با الکل.
سوال جالبیه الکل یک بیگانه بیوتیک است - موادی که در بدن انسان یافت نمی شود، اما بر عملکردهای حیاتی آن تأثیر می گذارد. همه چیز به دوز بستگی دارد.
- الکلیک ماده مغذی است که انرژی بدن را تامین می کند. در قرون وسطی، بدن حدود 25 درصد از انرژی خود را از طریق مصرف الکل دریافت می کرد.
- الکل دارویی است که دارای اثر ضد عفونی کننده و ضد باکتری است.
- الکل سمی است که فرآیندهای زیستی طبیعی را مختل می کند، اندام های داخلی و روان را از بین می برد و در صورت مصرف زیاد منجر به مرگ می شود.